
今回はカドミウム・銅還元カラムをもう少し深堀りしてみます。
FIA装置,OG-FI-310NOに組み込んで,EDTAを含むキャリヤー溶液が常に流れている状態で100%の還元力を発揮するカドミウム・銅還元カラムですが,現場で使用されるユーザーの皆さんにとって気になることのひとつが“耐久性”にあることは言うまでもなく,実際に“どれくらいの期間,またはどれくらいの検体数が還元力を維持したまま使用できるか”という問い合わせを数多く受けてきました。「○○ヶ月,○年」とか,「○○○○検体」という答えを期待してのお問い合わせだと思いますが,具体的に数値を示すことはとても難しいのです。100%の還元力を常に維持できると言っておきながらそれはなぜなのか?
カドミウム・銅還元カラムの耐久性
それは,分析する試料の性状によって状況が大きく異なるからです。例えば,硝酸イオンの標準液だけを連続して注入し続ける場合,極端な話,ガラス管に充填してあるカドミウム・銅が溶けてなくなるまで,ものすごく長時間,100%の還元力を維持します。
また,例えば実試料の分析で言えば,保健所などで行われている飲料水検査で硝酸体窒素の分析項目に筆者の開発したFIAシステムが,ある自治体(県レベル)でお墨付きをいただき,実際の分析現場で使っていただきました。この試料(水道水や地下水と比較的きれいな水)の場合,「1週間に2日間程度,1日8時間の分析を行って,3年程度は使用することができた」という実績があります。しかも,交換するときでも還元率はほぼ100%が維持できていることもあるのです。残念ながら,3年も使うと充填してあるカドミウム・銅が溶けて量が半分以下となり,カラムに隙間ができてしまうことでピークがブロードになってピーク高も小さくなってしまうので,そこが交換時と決断をするわけです。
一方,最も用途として多い試料は,河川水,海水,工場排水,浸出水などの環境水だと思います。これらに含まれている成分は千差万別で,ひとくくりで耐久性について語ることができませんが,後述するような置換基を持った物質がカドミウム・銅の還元力を低下させることがわかっていますので,それらを含まないか,その濃度が低い試料の場合には飲料水などと同様に高い還元率が得られます。しかし,妨害物質を一定量含む試料を分析する場合は要注意です。
さて,どのような物質が還元を妨害するか?ひとつの実例で説明します。筆者も経験してびっくり驚いた試料が,医学,臨床分野の細胞培養液中の硝酸イオンの分析実験の現場にありました。細胞培養液を渡されて,通常通り,100µLを装置に注入したところピークが全く出ませんでした。不安になり,硝酸イオンの標準液を注入してもピークが出ません。亜硝酸イオンを注入すると予定通りの高さのピークを検出できました。このことから還元率がほぼ0%になってしまい検出ができず,カドミウム・銅還元カラムの機能が失われたことがわかりました。細胞培養液に含まれる物質のうち還元を妨害する可能性のある物質を検証してみたところ,犯人は培養液に元々含まれているメルカプトエタノール(C2H5SH)であろうことがわかりました。おそらくSH基がカドミウムと硫化物を形成してしまい活性が失われるのではないかと推測しました。次に同じように硫黄原子を分子内に持つL-シスチン,L-システインを含む培養液を使って詳細に還元率が低下する現象を確認しました。
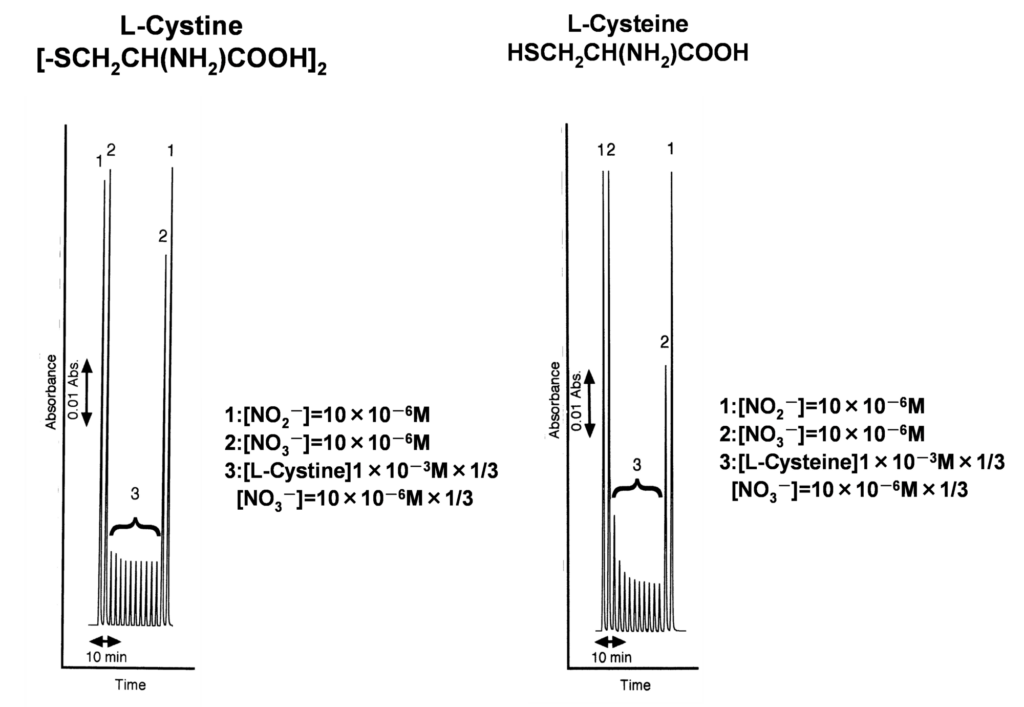
図1に示す通り,最初に還元率が100%であることを確認してから培養液を10回注入します。その後,再度硝酸,亜硝酸イオン標準液を注入して還元率をみたところ,試料の分析ピークも徐々に小さくなり,最終的にL-シスチンで80%,L-システインで約50%にまで還元率が低下していることがわかりました。硫黄原子を持つ化合物はやはり還元率を低下させることがわかります。妨害の程度は-SH > S-S-基の順で,-SHに結合する置換基としては低級であるほど妨害が強い傾向にあります。従って,環境水試料の中でも硫化水素や低級のメルカプタンを含有するような試料はカドミウム・銅の還元を妨害し,しかも活性力維持に効果的なキャリヤー溶液を流し続けても還元率が復活しないことがわかりました。このような試料では,1回注入しただけでもカドミウム・銅還元カラムを不活性化にしてしまいますので要注意です。 細胞培養液の実験の場合は硫黄化合物を添加している場合がありますが,血液などの臨床試料も分子内に硫黄原子を有する物質を含んでいる可能性があります。そこで,これらの臨床試料にカドミウム・銅還元カラムを適用するための前処理法を,臨床試料全般の前処理に適用されている除タンパク法を中心に検討しました。その結果,かなり古くから使われている硫酸亜鉛と水酸化ナトリウムを用いるSomogyi-Nelson法に効果があることがわかりました。還元力を低下させる原因を「硫黄原子がカドミウムと結合して硫化物を形成してカドミウムの表面を不活性化させる」ためと想定するとSomogyi-Nelson法の有効性が想定できます。その妨害除去機構を図2で説明します。硫酸亜鉛と水酸化ナトリウムで水酸化亜鉛を形成します。これにたんぱく質が共沈して除去できるのがこの除タンパク方法の原理ですが,この反応の前後で硫黄原子と亜鉛が硫化物を形成したり,水酸化亜鉛と硫黄原子が硫化物を形成して沈殿となり除去できるのではないかと推測しています。Somogyi-Nelson法は血液成分やその他の試料の除タンパク法として機能するばかりでなく,硫黄原子を含む低分子量の物質も除去できる方法であることがわかりました。
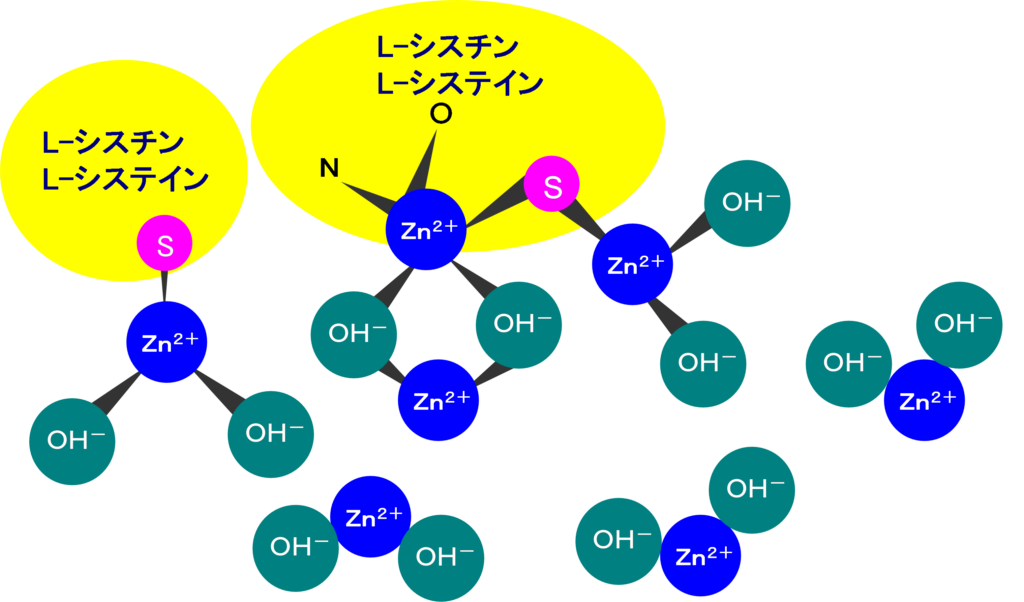
このSomogyi-Nelson法の前処理をL-シスチン,L-システインを含む培養液の分析に応用したところ図3に示すように培養液を10回注入してもピーク高は一定で,注入後の還元率の低下も起こっていないことが検証できました。

以上の考察や実験結果から,カドミウム・銅還元カラムによる定量的な還元を妨害する物質のひとつに硫黄原子を持つ物質をあげることができ,臨床試料はもとより,環境水試料においてもこのことをしっかり念頭において分析を行う必要があることがわかりました。そしてこの種の妨害物質の除去方法のひとつにSomogyi-Nelson法が有効な場合があることも対策のひとつとして考えていただければ幸いです。さらにこの機構を応用して操作をカスタマイズすれば新たな妨害除去方法も確立できるのではないでしょうか。
いずれにしても弊社のFIA装置,カドミウム・銅還元カラムを備えたOG-FI-310NOによれば常に100%の硝酸イオンの還元を可能にして硝酸体窒素分析の精度と信頼性を大きく向上させることができます。さらに,もうひとつのカドミウム・銅還元カラムシステムの大きなメリットが,「バッチ法では必須の洗浄や活性化など煩わしいメンテナンス操作が一切必要ない」ということです。カドミウム・銅還元カラムに常にEDTAを含むキャリヤー溶液が流れていて,装置が停止しているときはこのキャリヤー溶液に満たされている限り,という条件はありますが,通常の使い方そのものですね。
最後に筆者の残された疑問を挙げておきたいと思います。
まだ解明できないカドミウム・銅の正体,銅のお役目は?
「なぜ,1回の注入で還元力が0%になってしまうことがあるのか?」ということです。
試料はわずか100µLしか注入しておらず,還元カラムに充填されているカドミウムの量からすれば還元率が0%にまで落ちてしまうほどの妨害物質の負荷量でしょうか?実際に活性なカドミの表面は2回目の注入の際も存在していて,還元力としては100%とまでいかなくとも,まだ残っているのではないかと思うのです。とすれば,想定とは違う妨害反応が起こっているかもしれません。筆者は「カドミウム・銅」の「銅」に注目しています。還元の反応式には銅は登場してきませんが,銅の本当の「役目」は何であるか?興味を覚えます。この「1回の注入で0%にしてしまう」現象に答えが隠されているかもしれません。ちなみに,市販の試薬の「カドミウム・銅」の外観は,銅の赤味のある色は見られません。色を呈さない程度の少量しか付いていないのか?バッチ法でカドミウム・銅をカラムに充填して活性化液(硫酸銅を含む)を流した後に金属表面が赤味を帯びることがあります。バッチ法で還元率が維持できない現象から,「銅」が多く付き過ぎても良くないのか?…
化学反応の面白さに興味は尽きません。
筆者の疑問にご回答いただける方はぜひご一報,ご教授ください。
【参考文献】K. Higuchi, S. Motomizu, Anal. Sci., 15, 129-134(1999).
